wo. 14 mei 2025
Sterke vooruitgang in ontwikkeling van HAE-medicijn bij biotechbedrijf Phavaris

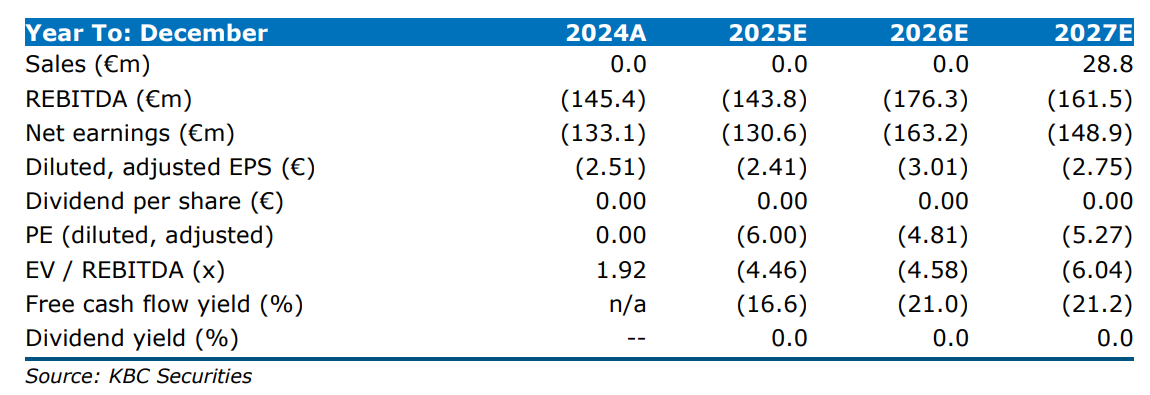
Pharvaris meldt bij de eerstekwartaalresultaten een kaspositie van 236 miljoen euro. Eind 2024 was dat nog 281 miljoen euro, waardoor het bedrijf het financieel kan rekken tot het derde kwartaal van 2026, berekende KBC Securities-analist Jacob Mekhael. Pharvaris maakte ook nieuwe studieresultaten bekend.
Pharvaris?
Pharvaris is een Nederlands biotechbedrijf dat deucrictibant* ontwikkelt voor HAE**. Jacob ziet Pharvaris als een aantrekkelijke investeringscase vanwege de competitieve studieresultaten van deucrictibant. Het heeft hogere potentie dan huidige middelen op de markt en het wordt oraal toegediend. Voor patiënten is het een extra gemak dat het medicijn via de mond wordt ingenomen en geen inspuiting vereist.
*Deucrictibant is een medicijn dat de bradykinine B2-receptor (B2R) blokkeert. Bradykinine is het peptide dat onder meer een rol speelt in het veroorzaken van ontsteking en pijn. Door de B2-receptor te blokkeren, kan het medicijn helpen bij het verminderen van symptomen zoals zwelling en pijn die geassocieerd worden met aandoeningen zoals hereditair angio-oedeem (HAE).
**Hereditair angio-oedeem (HAE) is een zeldzame genetische aandoening die wordt gekenmerkt door terugkerende episodes van ernstige zwelling (angio-oedeem). Deze zwellingen kunnen voorkomen in verschillende delen van het lichaam, waaronder de handen, voeten, gezicht, luchtwegen en het maagdarmkanaal.
HAE wordt veroorzaakt door een tekort aan of disfunctie van een eiwit genaamd C1-esteraseremmer, wat leidt tot een overmatige productie van bradykinine, een stof die de bloedvaten verwijdt en lekkage van vocht in de weefsels veroorzaakt.
Nieuwe studieresultaten van deucrictibant zijn goed
In een fase 2-studie* in de HAE-profylaxe setting (een preventieve behandeling die mogelijke aanvallen moet onderdrukken, in plaats van acute aanvallen te behandelen) bereikte deucrictibant een afname van de maandelijkse aanvallen met 85% vergeleken met een placebo, waarmee het even goed doet als de huidige standaardzorg, zijnde Takhzyro, een geneesmiddel van Takeda Pharmaceutical Company Limited, dat twee keer per maand via een inspuiting toegediend moet worden.
*klinische proef waarbij een nieuw geneesmiddel wordt getest op een grotere groep mensen om de effectiviteit en veiligheid ervan te beoordelen. In deze fase wordt meestal onderzocht hoe goed het middel werkt tegen een specifieke aandoening en worden de optimale doseringen bepaald.
Een fase 3-studie* is momenteel aan de gang en als de uitkomst even goed is als de fase 2-resultaten, kan deucrictibant de nieuwe standaardzorg voor HAE-profylaxe worden, stelt Jacob. De fase 3-studieresultaten worden in de eerste helft van 2026 verwacht.
*Klinische proef waarbij een nieuw geneesmiddel of behandeling wordt getest op een nog grotere groep mensen dan in de fase 2 om de effectiviteit en veiligheid ervan verder te bevestigen. In deze fase wordt het middel vergeleken met bestaande behandelingen of een placebo om te bepalen hoe goed het werkt en om eventuele bijwerkingen te identificeren. Het doel is om voldoende gegevens te verzamelen om de goedkeuring van regelgevende instanties te verkrijgen voor algemeen gebruik.
Vrijstelling van FDA
Pharvaris ontving ook een vrijstelling van het Amerikaanse geneesmiddelenagentschap (FDA) voor een grondige QT-studie* na beoordeling van preklinische en klinische datapakketten. Phavaris zal op 4 juni zijn plannen onthullen om deucrictibant uit te breiden naar mensen met HAE type 1/2.
*Een thorough QT-studie (TQT-studie) is een klinische studie die wordt uitgevoerd om de effecten van een geneesmiddel op het QT-interval van het hart te beoordelen. Het QT-interval is een maat voor de tijd die het hart nodig heeft om zich voor te bereiden op de volgende hartslag. Verlenging van het QT-interval kan wijzen op een verhoogd risico op ernstige hartritmestoornissen.
KBC Securities over Pharvaris
Gezien de historische zorgen over de cardiovasculaire impact van B2R-antagonisme, ziet Jacob de vrijstelling van de FDA als bijkomende bevestiging van het veiligheidsprofiel. Op korte termijn kijkt hij uit naar meer informatie over de plannen van het bedrijf om uit te breiden buiten HAE type 1/2 tijdens het infomoment op juni 2025.
Jacob ziet Pharvaris als uniek gepositioneerd in de HAE-ruimte, met het potentieel om de enige hoog-efficiënte orale optie te bieden voor de lucratieve profylactische markt. Hij bevestigt zijn koersdoel van 32 dollar en de ‘Kopen’-aanbeveling voor het bedrijf.