ma. 29 sep 2025

Dat UCB met Bimzelx een goudhaantje in het Anderlechtse hoofdkwartier heeft rondlopen, blijkt uit de studieresultaten van concurrent MoonLake Therapeutics. Maar welke kuikens zitten er nog in de pijplijn bij UCB? Antje Witte, die de relaties met de UCB-investeerders verzorgt, kwam de pijlijn vorige week voorstellen.
UCB?
UCB is een in België gevestigd biofarmaceutisch bedrijf dat gespecialiseerd is in twee therapeutische gebieden: ziekten van het centrale zenuwstelsel (CZS) en immunologie.
Op het gebied van aandoeningen van het centrale zenuwstelsel richt het bedrijf zich op epilepsie, het Dravetsyndroom, het LennoxGastautsyndroom, myasthenia gravis, rustelozebenensyndroom en de ziekte van Parkinson, en het immunologiegebied omvat reumatoïde artritis, osteoporose, psoriasis, artritis psoriatica, axiale spondyloartritis, hidradenitis suppurativa, de ziekte van Crohn, lupus en juveniele idiopathische artritis.
De productportefeuille omvat geneesmiddelen zoals Cimzia, Vimpat, Keppra, Briviact, Neupro, Fintepla, Nayzilam, Bimzelx, Evenity, Rystiggo, Zilbrysq en zijn gevestigde merken. Het bedrijf is actief in ongeveer 40 landen en heeft meer dan 7.500 mensen in dienst.
Geneesmiddelen in ontwikkeling
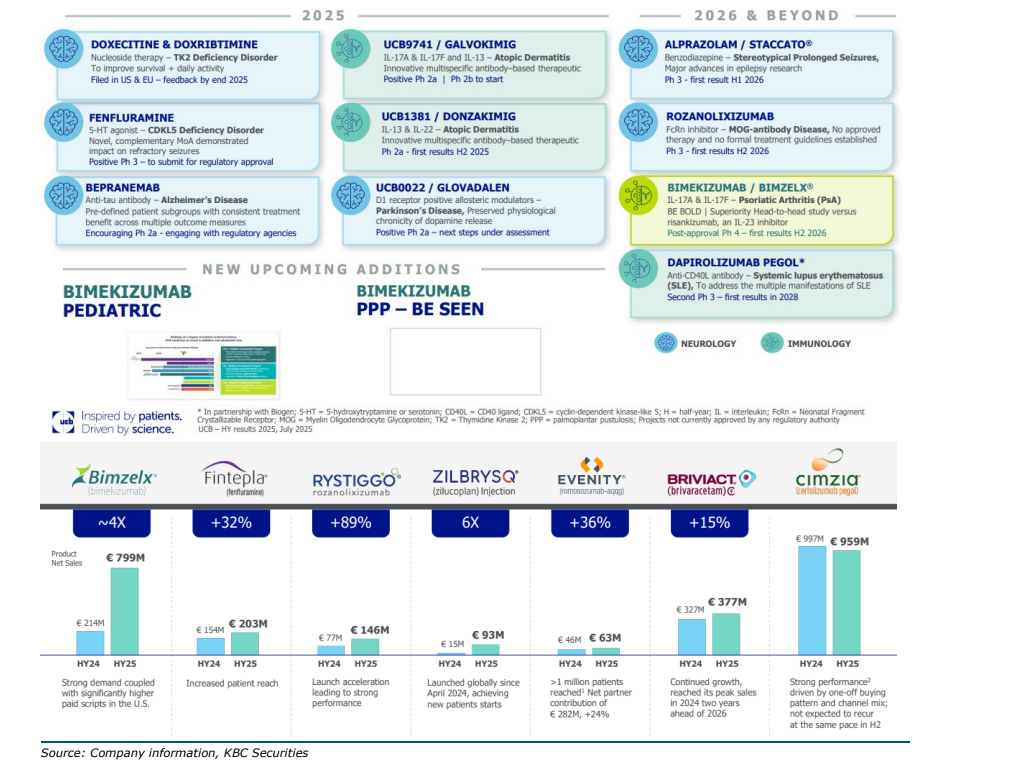
- Doxecitine
Doxecitine is een experimenteel geneesmiddel dat wordt ontwikkeld voor de behandeling van Thymidinekinase 2-deficiëntie (TK2d). TK2d is een uiterst zeldzame, genetische mitochondriale aandoening die leidt tot ernstige spierzwakte, ademhalingsproblemen en voedingsmoeilijkheden. Wereldwijd zijn er minder dan 2.000 patiënten met deze ziekte.
Volgens recente onderzoeksresultaten heeft Doxecitine de mortaliteit aanzienlijk verlaagd, de overlevingskansen verhoogd, Functionele uitkomsten verbeterd, zoals het behouden of herwinnen van motorische mijlpalen, Het gebruik van beademings- en voedingsondersteuning gestabiliseerd.
UCB hoopt het middel in 2025 op de markt te brengen, wat belangrijk is voor de cashflowbasis van het bedrijf. Hoewel het commercieel klein is in vergelijking met bijvoorbeeld Bimekizumab, is het strategisch van groot belang omdat het vaste inkomsten kan genereren en levensreddend is.
- Fenfluramine
Fenfluramine is een geneesmiddel dat door UCB wordt gecommercialiseerd onder de naam Fintepla. Het is een orale oplossing die wordt gebruikt als aanvullende behandeling bij epilepsie, specifiek voor zeldzame en ernstige vormen zoals: Dravet-syndroom*, Lennox-Gastaut-syndroom** (LGS), CDKL5-deficiëntiestoornis*** (CDD).
*Dravet-syndroom: een zeldzame, moeilijk behandelbare vorm van epilepsie die begint in de kindertijd. Fintepla is goedgekeurd in de VS, EU en Japan als aanvullende therapie voor patiënten vanaf 2 jaar.
**Lennox-Gastaut-syndroom (LGS): een andere zeldzame vorm van epilepsie bij kinderen. Fintepla werd in februari 2023 volledig goedgekeurd in de EU voor deze indicatie. De goedkeuring is gebaseerd op positieve fase 3-resultaten en een open-label extensiestudie die langdurige werkzaamheid en veiligheid bevestigde.
***CDKL5-deficiëntiestoornis (CDD): een ultra-zeldzame epileptische aandoening die begint in de eerste levensweken. In juni 2025 kondigde UCB positieve fase 3-resultaten aan voor Fintepla bij CDD, met significante vermindering van motorische aanvallen en een gunstig veiligheidsprofiel. UCB plant een snelle indiening voor goedkeuring
Fintepla is een 5-HT agonist (serotonine-achtige werking) die de frequentie van aanvallen vermindert. In klinische studies werd een reductie van meer dan 60% in convulsieve aanvallen waargenomen bij een dosering van 0,7 mg/kg/dag. Hoewel het middel een FDA black box warning heeft voor mogelijke hartproblemen (zoals pulmonale hypertensie), zijn er tot nu toe geen gevallen van hartklepaandoeningen gemeld dankzij de lage dosering die UCB hanteert.
Stand van zaken en volgende stappen:
- Dravet & LGS: goedgekeurd en gecommercialiseerd in de VS, EU, Japan.
- CDD: positieve fase 3-resultaten, indiening voor goedkeuring gepland.
- Langetermijnstudies: open-label extensiestudies tonen geen nieuwe veiligheidsproblemen en bevestigen duurzame werkzaamheid.
UCB verwacht dat Fintepla tegen het einde van dit decennium een piekomzet van 1 miljard euro zal bereiken.
- Bepranab
Bepranab is ontwikkeld voor de behandeling van Alzheimer, een neurodegeneratieve aandoening die leidt tot geheugenverlies, cognitieve achteruitgang en uiteindelijk verlies van zelfstandigheid.
Het middel is een anti-tau antilichaam. Tau-eiwitten spelen een centrale rol in de vorming van neurofibrillaire kluwens in de hersenen van Alzheimerpatiënten. Bepranab richt zich op deze tau-eiwitten en probeert hun schadelijke werking te blokkeren. Uit de fase 2a-studie blijkt dat het middel consistente voordelen biedt in vooraf gedefinieerde patiëntengroepen, en dat het positieve effecten heeft op meerdere uitkomstmaten. De fase 2a-resultaten zijn dus bemoedigend, wat betekent dat het middel een goede basis heeft om verder te ontwikkelen.
Volgende stappen: UCB is momenteel in overleg met regelgevende instanties om de volgende klinische fase en goedkeuringsproces vorm te geven
- Galvokimig
Galvokimig is bedoeld voor de behandeling van matig tot ernstig atopisch eczeem (atopic dermatitis), een chronische huidaandoening die gepaard gaat met jeuk, ontsteking en huidletsels.
Het middel is een multi-specifiek antilichaam dat drie ontstekingsbevorderende cytokines tegelijk remt: IL-13, IL-17A en IL-17F. Dankzij albuminebinding heeft het een verlengde halfwaardetijd, wat betekent dat het langer actief blijft in het lichaam.
In de fase 1/2a-studie toonde Galvokimig sterke resultaten:
- 52,6% placebo-gecorrigeerde respons op het primaire eindpunt (EASI75: 75% verbetering in ernst en oppervlakte van eczeem na 12 weken).
- 43,1% placebo-gecorrigeerde respons op EASI90.
- De meest voorkomende bijwerkingen waren mild: rhinitis, hoofdpijn, keelpijn en duizeligheid.
UCB plant een fase 2b-studie tegen eind 2025, wat een belangrijke stap is richting goedkeuring en commercialisering.
Galvokimig presteert beter dan Dupixent (Sanofi), dat momenteel marktleider is in deze indicatie. Dupixent haalde in 2024 een omzet van 14 miljard dollar, wat het commerciële potentieel van Galvokimig onderstreept.
- Donzakimig
Net als Galvokimig is Donzakimig is ontwikkeld voor de behandeling van atopische dermatitis (AtD)..
Werking: Het middel is gericht op het tegengaan van ontstekingsprocessen via remming van de cytokines IL-13 en IL-22, die een centrale rol spelen in de pathofysiologie van AtD. Dit werkingsmechanisme is complementair aan bestaande behandelingen zoals Dupixent (Sanofi), dat zich richt op IL-4 en IL-13.
Er zijn nog geen klinische data gepubliceerd. De eerste resultaten worden verwacht eind februari 2026, bij de bekendmaking van de jaarcijfers. Deze resultaten zullen cruciaal zijn om te bepalen of het middel doorstroomt naar fase 3.
- Glovadalen
Glovadalen is ontwikkeld voor de behandeling van Parkinson, een neurodegeneratieve aandoening die gepaard gaat met symptomen zoals tremor, stijfheid en instabiliteit.
Het middel is een D1-receptor positieve allosterische modulator. Dat betekent dat het de dopamine D1-receptor activeert op een manier die de fysiologische afgifte van dopamine behoudt. Dit is belangrijk omdat dopamine een cruciale rol speelt in de motorische controle, en het verlies van dopaminerge neuronen een kenmerk is van Parkinson.
Glovadalen heeft positieve fase 2a-studieresultaten behaald. De data worden binnenkort gepresenteerd op een wetenschappelijk congres. UCB is momenteel bezig met het beoordelen van de volgende stappen in het ontwikkelingsproces. Dit kan leiden tot een fase 2b- of fase 3-studie, afhankelijk van de feedback van regelgevende instanties en verdere analyse van de data.
- Staccato
Staccato is gericht op de behandeling van stereotiepe langdurige epileptische aanvallen (prolonged seizures). Deze aanvallen vereisen snelle interventie om complicaties en ziekenhuisopnames te voorkomen.
Het middel bevat alprazolam, een benzodiazepine, en wordt toegediend via een inhalatiesysteem. Dankzij deze toedieningsvorm kan het geneesmiddel zeer snel in de bloedbaan worden opgenomen, wat cruciaal is bij acute epileptische aanvallen.
Staccato bevindt zich momenteel in fase 3 van klinische ontwikkeling. De oorspronkelijke planning voorzag een eerste resultaat in 2024, maar dit is uitgesteld naar de eerste helft van 2026. UCB zal de eerste fase 3-resultaten van Staccato in 2026 bekendmaken. Deze resultaten zullen bepalend zijn voor een eventuele aanvraag tot goedkeuring bij regelgevende instanties.
- Rozanolixizumab
Rozanolixizumab, ook bekend onder de merknaam Rystiggo, is ontwikkeld voor de behandeling van generalized myasthenia gravis (gMG). Dit is een zeldzame auto-immuunziekte waarbij het lichaam antistoffen aanmaakt tegen onderdelen van de neuromusculaire verbinding, wat leidt tot spierzwakte.
Rozanolixizumab is een FcRn-remmer (neonatale Fc-receptor inhibitor). Het blokkeert het FcRn-eiwit, dat normaal zorgt voor de recycling van IgG-antilichamen. Door deze blokkering worden pathogene IgG-antilichamen sneller afgebroken, wat leidt tot een vermindering van de auto-immuunreactie.
Het middel wordt subcutaan toegediend (onderhuidse prik), wat het geschikt maakt voor zelftoediening door patiënten. Dit verhoogt het gebruiksgemak en de therapietrouw.
Stand van zaken:
- Rozanolixizumab kreeg in juni 2023 goedkeuring van de FDA voor de behandeling van gMG bij volwassenen met anti-AChR of anti-MuSK antistoffen.
- Het middel werd ook goedgekeurd in Japan en kreeg een positieve CHMP-opinie in Europa, wat betekent dat een EU-goedkeuring in de maak is.
- De goedkeuring is gebaseerd op de pivotal fase 3 MycarinG-studie, die statistisch significante verbeteringen toonde in gMG-specifieke uitkomstmaten.
Volgende stappen:
- UCB verwacht verdere goedkeuringen in Europa tegen eind 2025.
- Rozanolixizumab maakt deel uit van UCB’s gMG-tandem, samen met Zilucoplan, en vormt een strategisch antwoord op concurrent Argenx met Vyvgart.
- UCB voorziet een piekomzet van 700 miljoen euro voor Rozanolixizumab.
- Dapirolizumab Pegol
Dapirolizumab Pegol is ontwikkeld voor de behandeling van systemische lupus erythematodes (SLE), een chronische auto-immuunziekte die meerdere orgaansystemen aantast en vooral jonge vrouwen treft. Het middel wordt samen met het Amerikaanse Biogen ontwikkeld.
Het middel is een Fc-vrij antilichaamfragment dat zich richt op CD40L, een eiwit dat betrokken is bij ontstekingsprocessen zoals B-celactivatie, autoantilichaamproductie, interferonsecretie en T-cel/APC-activatie. Door CD40L te blokkeren, remt Dapimap meerdere ontstekingsroutes die bijdragen aan de ziekteactiviteit bij SLE.
Dapimap wordt gezien als een concurrent voor Benlysta (GSK) en Saphnelo (AstraZeneca), die respectievelijk 1,68 miljard dollar en 280 miljoen dollar omzet behaalden in 2023. UCB en Biogen delen de inkomsten 50/50. De geschatte piekomzet ligt net onder 1 miljard dollar tegen het midden van de jaren 2030.
- Bimekizumab Pediatric
Bimekizumab Pediatric is een pediatrische toepassing van het geneesmiddel Bimekizumab (merknaam: Bimzelx), gericht op de behandeling van psoriasis bij kinderen. Psoriasis is een chronische ontstekingsziekte van de huid die ook bij jonge patiënten voorkomt, maar vaak pas laat wordt gediagnosticeerd.
Bimekizumab is een dubbele IL-17A/IL-17F-remmer. Deze cytokines spelen een centrale rol in de ontstekingscascade bij psoriasis. Door beide tegelijk te blokkeren, biedt Bimekizumab een krachtige en snelle verlichting van symptomen, zoals huidletsels en jeuk.
Stand van zaken: UCB onderzoekt momenteel de toepassing van Bimekizumab bij jonge kinderen, waarbij het traject van diagnose tot behandeling vaak 7 tot 8 jaar duurt. De pediatrische studies zijn nog in een vroeg stadium, maar maken deel uit van UCB’s bredere strategie om voor elke patiënt een oplossing te bieden, ongeacht leeftijd.
- Bime PPP – BE SEEN
Indicatie: Pustuleuze psoriasis (PPP), een zeldzame en ernstige vorm van psoriasis. De BE SEEN-studie onderzoekt de effectiviteit van Bimekizumab bij PPP. De klinische studie is gestart, verdere resultaten worden verwacht in de komende jaren.
Nog wat extraatjes
- UCB investeert 29% van zijn inkomsten in R&D (onderzoek en ontwikkeling) wat aanzienlijk hoger is dan gemiddeld. Gezien de inkomsten de komende jaren zullen stijgen, zal het kapitaal voorzien voor onderzoek en ontwikkeling mee stijgen. UCB wil zo blijvend inzetten op innovatie.
- UCB start altijd vanuit de patiënt, ontwikkelt via platformen en keert voortdurend terug naar de patiënt voor feedback.
- 86% van de fase 3-studies bij UCB zijn succesvol, tegenover een gemiddeld succespercentage in de sector van 57%.
- Vooruitzichten voor 2025: minstens 7 miljard euro omzet dankzij geneesmiddelen zoals Bimzelx, Fintepla, Rystiggo, Zilsbrysq, Evenity en Briviact.
- Bimekizumab heeft 25% marktaandeel in de VS en presteert uitstekend.
- UCB blijft actief in China via partners en leert uit eerdere samenwerkingen in Japan.
- Er wordt een bioplant gebouwd in de VS (investering van 2 miljard euro) om te voldoen aan de groeiende vraag naar Bimzelx.